Vaccini antitumorali e scoperte genetiche: la scienza è ricerca e collaborazione
5 min letturaScrivendo qualche post su scienza e ricerca, ho insistito spesso sul fatto che dobbiamo dimenticare l'immagine romantica dello scienziato geniale che in splendida solitudine, ancora meglio se andando in direzione ostinata e contraria che c'è anche odore di martirio, si inventa dal nulla qualcosa di eccezionale. Come per esempio una cura per il cancro, o una terapia per non invecchiare, a cui nessun altro aveva pensato prima.
Non funziona così, o non funziona più così, i problemi affrontati sono troppo complessi. La scienza ovviamente richiede preparazione, competenza, motivazione, determinazione, ma non bastano. È soprattutto un processo cumulativo di condivisione (orizzontale e verticale) di conoscenze, di informazioni, di dati.
Un mio risultato oggi, apparentemente senza un'applicazione immediata, non è inutile, non è conoscenza fine a sé stessa, potrà essere l'elemento che domani, o anche dopodomani, consentirà a qualcun altro di fare un passo avanti in più, magari di usarlo in modo concreto.
Forse quello che oggi non si sa o non si può fare, domani sarà possibile, e qualcuno lo farà. La conoscenza non è mai fine a sé stessa, serve a costruire nuova conoscenza e creare nuove possibilità.
Potrei fare tanti esempi illustri, ho scritto in passato di come si sia arrivati a una tecnologia rivoluzionaria come il CRISPR/Cas9 partendo dallo studio del genoma dei batteri in una salina, o come si sia arrivati a una terapia per il cancro (gli anticorpi anti PD1/PD-L1) partendo da studi di embriologia. Non sono stati casi di serendipità, non cercavo una cosa e per caso ne ho trovata un'altra, un altro mito a cui siamo tanto legati, la botta-di-fortuna! No, si trattava di dati prodotti regolarmente nell'ambito di un progetto, e poi lasciati a disposizione della comunità scientifica. Tempo dopo qualcuno ci ha visto qualcosa, li ha usati per continuare a costruire altra scienza. Che forse domani sarà la base di partenza per qualcun altro, in un processo di conoscenza progressivo che nel tempo aumenta, si libera dei propri dubbi e dei propri errori e conferma le proprie certezze.
Ma piuttosto vorrei raccontare una storia molto più piccola e personale.
Alcuni giorni fa ho avuto il piacere di vedere pubblicato un articolo su un modello (per ora solo sperimentale) di vaccino antitumorale che si basa anche sul lavoro fatto da me e dal gruppo in cui lavoravo, tanti anni fa. Conoscenza lasciata a disposizione, come bene comune, che oggi qualcuno ha ripreso e sta usando con nuove possibilità.
Nel laboratorio dove ero entrato come tesista si collaborava con il professor Edoardo Boncinelli allo studio del ruolo dei geni omeotici HOX nello sviluppo dell'embrione. Noi umani abbiamo 38 geni HOX diversi, originati da duplicazioni successive di un gene ancestrale milioni di anni fa, ognuno ha il suo ruolo e la sua finestra di attività durante l'embriogenesi.
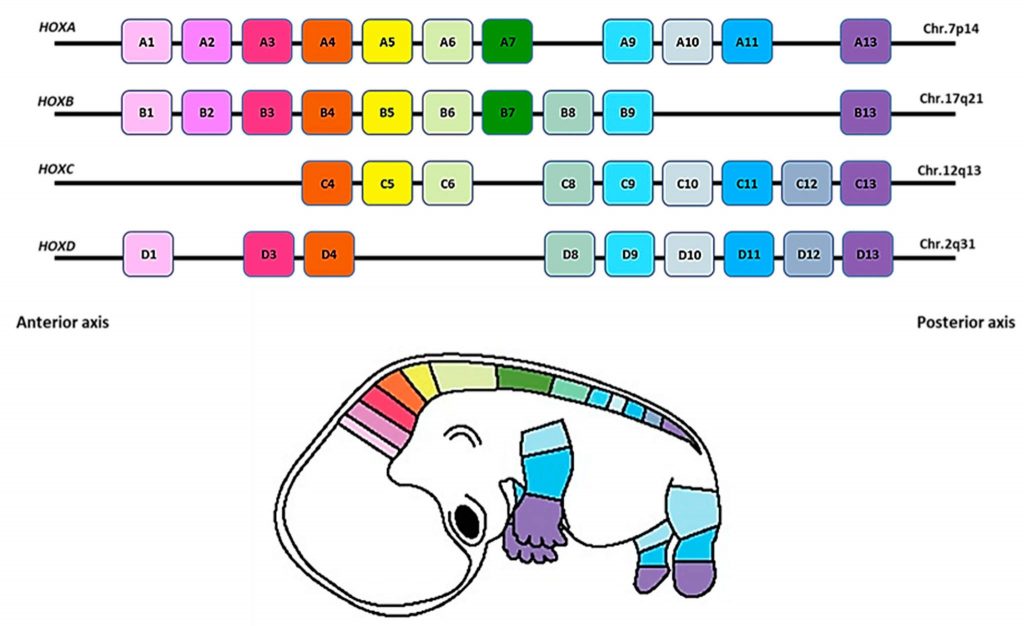
A seguito di una collaborazione con l'Istituto dei Tumori di Milano però scoprimmo che un gene HOX in particolare, chiamato HOXB7 era attivo in tutti i campioni di melanoma analizzati. Scoprimmo che HOXB7 non era attivo nei normali melanociti, ma si accendeva in alcuni nei (displasie) per aumentare nel melanomi in fase radiale (ancora superficiali) e in quella verticale (quelli che hanno scavato e invaso il derma in profondità, fino a diventare metastatici). Avevamo un gene che si attivava nel corso della progressione tumorale. Da lì avremmo scoperto molte altre cose sul ruolo di HOXB7 nella cancerogenesi e sui vari pathway in cui è coinvolto nella cellula tumorale. Lo avremmo confermato in un modello di tumore del seno, e altri gruppi dopo di noi lo avrebbero confermato in altri tumori approfondendo e confermando il nostro lavoro.
Sul come e perché un gene coinvolto nello sviluppo dell'embrione possa avere un ruolo nella cancerogenesi non mi dilungo in questa sede, ma il punto è che il ruolo di quel gene nel cancro era appurato. Il nostro primo articolo sull'argomento è stato pubblicato nel 1996.
Diciotto anni dopo un gruppo di ricercatori (per inciso, sempre del mio istituto ma di altra struttura e con altre competenze ) ha pubblicato un articolo in cui, basandosi sul ruolo di HOXB7 nel tumore, propone una tecnologia (a cui lavorano da tempo) per un vaccino antitumorale. Che quando studiavamo il ruolo di HOXB7 nel cancro, mica potevamo pensare a un vaccino noi…
Per chi è curioso, il vaccino consiste in una sequenza di DNA codificante per un gene che ci interessa (chiamiamolo P), legata alla sequenza codificante per una forma mutata della proteina Nef di HIV-1 (alcuni colleghi sono virologi che hanno lavorato a lungo su HIV-1) in modo tale che venga prodotta una proteina unica. Il DNA iniettato infatti sarà tradotto come proteina di fusione Nef-P nelle cellule muscolari (sito dell'iniezione).
Ora, la proteina Nef mutata ha un'alta affinità per i lipidi che costituiscono la parete di minuscole vescicole che tutte le cellule rilasciano per segnalare e mandare in giro messaggi sotto forma di macromolecole, le vescicole extracellulari (EV). Quindi dopo la vaccinazione le cellule muscolari rilasceranno vescicole extracellulari contenenti la proteina Nef, da un lato ancorata alle vescicole, dall'altro fusa alla proteina di interessa P. Queste vescicole arriveranno anche alle cellule APC (Antigen Presenting Cells) che presenteranno le proteine contenute al loro interno come antigeni ai linfociti T CD8. Una volta attivati contro P, i CD8 attaccheranno tutte le cellule che contengono P.
In questo caso nel ruolo di P i colleghi hanno usato il DNA che codifica per HER2 e per HOXB7. Di HOXB7 abbiamo già detto. HER2 è un recettore per l'Epidermal Growth Factor, ed è un fattore ben noto per il suo ruolo di spinta alla proliferazione in molti tumori, tanto che si è anche cercato di mettere a punto degli inibitori specifici.
Purtroppo quando ci si concentra su un solo target spesso l'effetto è limitato nel tempo perché il tumore riesce ad aggirare il blocco nascondendo il target, modificandone la struttura con nuove mutazioni, o affidandosi a fattori di crescita alternativi. Nel caso specifico dell'immunoterapia poi c'è un problema in più, ed è che spesso quelli che vorremmo usare come target non sono dei veri TAA (antigeni tumorali specifici) perché non sono proteine mutate specifiche per il tumore. Non sempre, infatti, i tumori si affidano all'attività di geni mutati, ma solo molto più abbondanti perché magari duplicati, amplificati, deregolati, ma la proteina è normale ed il sistema immunitario sarà tollerante alla loro presenza.
L'idea di questo vaccino, quindi, è quella di stimolare con vaccinazioni ripetute il sistema immunitario ad attivarsi lo stesso contro queste proteine spingendolo a considerarle antigeni tumorali. E di farlo, usando due antigeni tumorali invece di uno solo.
I colleghi hanno vaccinato contro HER2 ed HOXB7 dei topi in cui poi saranno iniettate cellule tumorali (una linea cellulare di tumore della mammella) che ovviamente esprimono sia HER2 che HOXB7. I risultati presentati sono promettenti, i topi vaccinati contro doppio target (in rosso nel grafico) risultano protetti dai tumori sia in modo preventivo (dopo il vaccino non svilupperanno tumori) sia terapeutico (se hanno il tumore e poi vengono vaccinati).
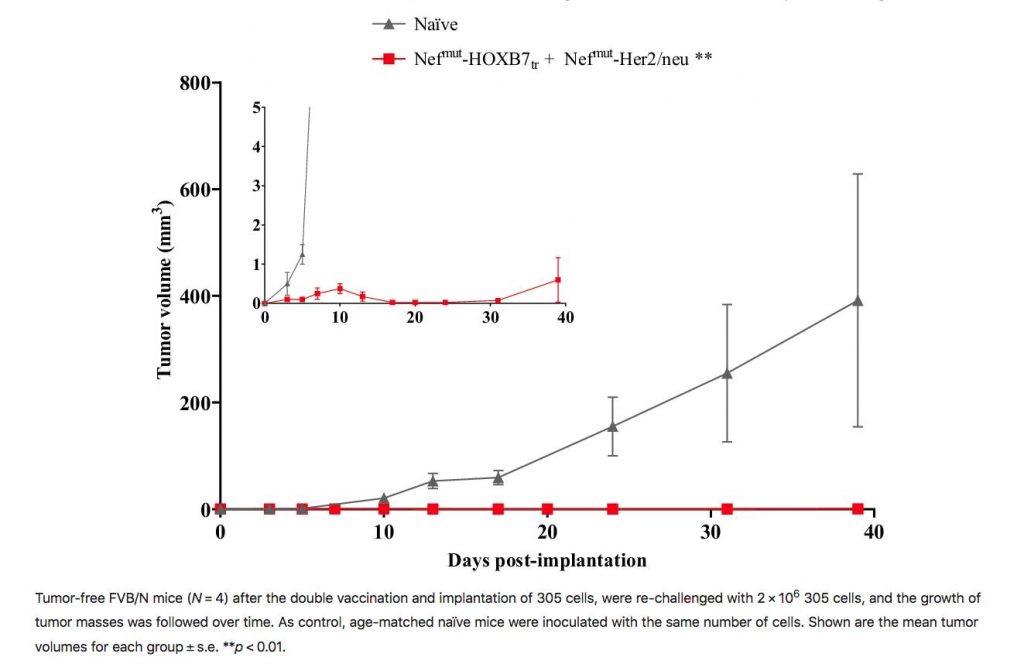
Per ora è solo un modello, vedremo se diventerà qualcosa in più. Ma è la conferma che il lavoro fatto oggi potrà servire domani, quando magari sarà disponibile una tecnologia, o conoscenze, che oggi non abbiamo. E poi chissà.
Immagine in anteprima via mayo.edu







