COVID-19: la corsa al vaccino fra scienza, nazionalismi e solidarietà globale
27 min letturaParte 1
Parte 2 (Dal capitolo "Ma si può davvero arrivare ad avere un vaccino in 18 mesi?")
"Avremo un vaccino entro 12-18 mesi". È la frase che stiamo ascoltando su tutti i media da parte di aziende produttrici di vaccini, politici, alcuni medici, sin dall'inizio della pandemia. Da quando SARS-CoV-2 ha cominciato a diffondersi praticamente in tutto il mondo è iniziata una vera e propria corsa per la realizzazione di un vaccino, ritenuto la soluzione per debellare o quantomeno arginare l'infezione da nuovo coronavirus tra la popolazione mondiale. Governi, case farmaceutiche e laboratori di ricerca stanno producendo uno sforzo a un ritmo mai visto prima nella storia della ricerca medica. Attualmente ci sono 328 trattamenti e 118 vaccini in sperimentazione.
Leggi anche >> La corsa geopolitica al vaccino che rischia di minare la fiducia dei cittadini
A fine aprile, Tedros Adhanom Ghebreyesus (direttore generale dell'Organizzazione Mondiale della Sanità - OMS), Ursula von der Leyen (presidente della Commissione europea), Emmanuel Macron (presidente della Francia) e Melinda Gates (co-presidente della Fondazione Bill e Melinda Gates) hanno presentato ACT Accelerator, un'iniziativa globale per accelerare lo sviluppo di test, farmaci e un possibile vaccino contro il COVID-19 e assicurarsi che tutto il mondo abbia accesso a queste cure. Il progetto ha raccolto più di 8 miliardi di dollari e coinvolge, al momento, Italia, Spagna, Germania, Regno Unito, Finlandia, Costa Rica, Sudafrica, Ruanda, Arabia Saudita e Malaysia, ma non gli Stati Uniti (che hanno recentemente sospeso il loro finanziamento all'OMS). L'obiettivo di ACT Accelerator, aveva dichiarato in sede di presentazione Von der Leyen, è quello di sviluppare nel più breve tempo possibile e rendere accessibile in tutti gli angoli del mondo diagnostica, terapie e trattamenti. Per farlo, attingerà anche alle competenze e alle infrastrutture già messe in atto dalle organizzazioni no profit che operano in tutto il mondo, tra cui Gavi, la Vaccine Alliance, la Federazione internazionale delle società della Croce Rossa e della Mezzaluna Rossa e Unitaid. «Battere il coronavirus richiederà un accesso prolungato su molti fronti. Abbiamo bisogno di una risposta globale a una pandemia globale», aveva commentato la presidente della Commissione europea.
All'iniziativa globale, come detto, non stanno partecipando gli Stati Uniti. Anche la Cina è impegnata in uno sforzo individuale anche se, di recente, durante la 73esima assemblea dell'OMS, il presidente Xi Jinping ha affermato che se Pechino dovesse trovare un vaccino contro il Covid-19 ne farebbe «un bene pubblico mondiale». Il 15 maggio il presidente USA Donald Trump ha presentato "Operation Warp Speed", un piano per «arrivare alla realizzazione di un vaccino entro la fine dell'anno, probabilmente anche prima». La Casa Bianca ha fissato come obiettivo quello di avere 100 milioni di dosi di vaccino entro l'autunno, ambizione che non gode di nessun sostegno scientifico. Trump ha paragonato "Operation Warp Speed" al "Progetto Manhattan", il programma di ricerca e sviluppo in ambito militare che portò alla realizzazione delle prime bombe atomiche durante la Seconda guerra mondiale: «È un progetto enorme e sarà veloce. I militari sono totalmente coinvolti», ha detto il presidente statunitense a proposito del piano alla cui guida ha messo il genero Jared Kushner e Moncef Slaoui, ex responsabile della ricerca della multinazionale GlaxoSmithKline ed ex membro del consiglio di amministrazione di Moderna, una delle aziende farmaceutiche impegnate nella realizzazione di un vaccino. Subito dopo aver ottenuto il nuovo incarico, Slaoui ha ceduto le azioni (per un valore di circa 10 milioni di dollari) e si è dimesso dal Consiglio d'Amministrazione dell'azienda farmaceutica, una delle tre ad aver ottenuto un finanziamento (430 milioni di dollari) dalla Barda, l'agenzia sulla ricerca che fa capo al Ministero della Salute, insieme alla Janssen Research & Devolepment, del gruppo Johnson&Johnson (456, 2 milioni) e la Protein Science, del gruppo Sanofi (30,7 milioni).
Ed è di questi giorni l'annuncio proprio di Moderna che il vaccino che sta sviluppando sembra essere promettente. Stando a quanto dichiarato il 18 maggio dal suo produttore, nella prima fase di test (che coinvolge 45 persone divise in tre gruppi) l'inoculazione del vaccino sembra aver generato degli anticorpi neutralizzanti contro il nuovo coronavirus equivalenti a quelli trovati nel plasma convalescente di coloro che si sono ripresi da COVID-19. Tuttavia, per quanto sia stata rilanciata praticamente dai media di tutto il mondo come una buona notizia che dà speranza nella corsa per la realizzazione di un vaccino contro il nuovo coronavirus, ci sono alcune perplessità su quanto dichiarato dall'azienda farmaceutica: innanzitutto, l'annuncio di Moderna riguarda test svolti su un numero molto limitato di persone (appena otto), tra i 18 e i 55 anni e il vaccino sperimentale non è stato ancora somministrato ad altre due fasce d'età, dai 55 ai 70 e dai 71 anni in su, in genere quelle dove si registrano più decessi a causa di COVID-19; ci sono dubbi anche sull'effettiva efficacia degli anticorpi perché dire che sono equivalenti a quelli presenti nel plasma convalescente non significa che automaticamente siano neutralizzanti; infine, questi dati preliminari non sono stati resi noti né in pre-print né in peer-review, sono stati presentati alla Food and Drug Administration (FDA) – che però non commenta gli studi ancora in corso – e pertanto non sono disponibili per la valutazione di esperti e scienziati. I primi studi, ha comunicato la casa farmaceutica, saranno disponibili in estate.
Resta, dunque, solo l'annuncio dell'azienda. Questo modo di comunicare i risultati delle sperimentazioni sui trattamenti contro COVID-19 attraverso comunicati stampa in assenza (e in sostituzione) degli studi specifici si sta facendo sempre più prassi consolidata. È come se un amministratore delegato di una società pubblica annunciasse una relazione favorevole sugli utili senza fornire dati finanziari di supporto: una prassi che la Securities and Exchange Commission (ndr, la Consob americana) non consentirebbe mai, commenta sul Washington Post William Haseltine, professore in pensione della Scuola di Medicina di Harvard e fondatore del dipartimento di ricerca su HIV/AIDS e sul cancro dell'università.
Comunicazioni potenti da un punto di vista mediatico che precedono di qualche settimana la pubblicazione dei risultati degli studi che poi non si rivelano all'altezza degli annunci iniziali, ma che hanno l'effetto immediato di rilanciare in borsa le azioni delle società produttrici dei farmaci. Lo abbiamo già visto con il remdesivir, l'antivirale annunciato dall'Istituto Nazionale per le Allergie e le Malattie infettive degli Stati Uniti (NIAID) e dalla casa farmaceutica che lo produce, Gilead, come il farmaco in grado di ridurre la degenza ospedaliera dei pazienti che contraggono la malattia e per il quale siamo ancora in attesa dei dati della ricerca a venti giorni dai comunicati stampa. Lo stiamo vedendo con Moderna.
La FDA, l’agenzia federale statunitense che si occupa dei farmaci e della loro autorizzazione, ha già approvato la Fase 2 per il vaccino (il cui obiettivo è verificare il funzionamento del farmaco e le quantità necessarie perché sia efficace) e Moderna ha già fatto domanda per la serie di test successivi, la Fase 3 (in cui analizzare l'efficacia complessiva somministrando il vaccino a un campione più grande di pazienti). Nel prosieguo dei test saranno somministrate solo dosi basse di vaccino. Quelle elevate (che hanno provocato febbre, dolori muscolari e mal di testa in tre degli otto pazienti coinvolti nello studio) saranno escluse non per gli effetti collaterali ma perché non necessarie ai fini della sperimentazione, ha dichiarato il dottor Tal Zaks, direttore medico di Moderna in un'intervista. «Più bassa è la dose, più vaccino saremo in grado di produrre. La domanda supererà di gran lunga l'offerta, quindi penso che ci sia un obbligo etico di procedere con la dose più bassa in modo da poter fare più vaccini possibili», ha detto Zaks. «Se questi studi andranno bene, alcune dosi di un vaccino potrebbero diventare disponibili per un uso diffuso entro la fine di quest'anno o l'inizio del 2021». Intanto, alla luce delle dichiarazioni dei giorni scorsi, il 18 maggio le azioni della casa farmaceutica sono salite del 25% e tutta Wall Street ha ottenuto il suo miglior risultato nelle ultime sei settimane.
A dinamiche simili abbiamo assistito anche nel caso del vaccino, noto come ChAdOx1 nCov-19, che sta sviluppando lo Jenner Institute dell'Università di Oxford (e alla cui realizzazione sta partecipando anche l'azienda Advent-Irbm di Pomezia), prosegue Haseltine. Prima, in un'intervista al New York Times, c'è stato detto che la sperimentazione sulle scimmie aveva dato esiti positivi perché sei macachi rhesus esposti a grandi quantità del nuovo coronavirus a 28 giorni di distanza non avevano presentato sintomi dopo che gli era stato somministrato il vaccino. Questi risultati, scriveva il New York Times il 27 aprile, mettevano l'Università di Oxford in posizione di vantaggio rispetto a tutti gli altri perché la sicurezza del vaccino sperimentato dallo Jenner Institute era già stata provata e andava valutata solo la sua efficacia e, alla luce di quanto affermato dai ricercatori del National Institutes of Health statunitense che avevano collaborato al test, i risultati ottenuti erano promettenti in vista delle sperimentazioni sull'uomo considerato che «il macaco rhesus è praticamente la cosa più vicina che abbiamo agli umani». «È un programma che sta procedendo molto, molto velocemente. Questo grande studio nel Regno Unito potrà essere un insegnamento utile anche per gli altri progetti», aveva aggiunto Emilio Emini, direttore del programma vaccinale della Bill and Melinda Gates Foundation che sta finanziando sette diverse sperimentazioni.
Poco più di due settimane dopo quelle dichiarazioni sono stati resi pubblici i risultati dei test in versione pre-print e i dati non sono così esaltanti come era stato fatto intendere. Non è vero che le scimmie sono state protette dalla vaccinazione e non hanno manifestato sintomi. Il vaccino ha offerto un po' di immunità e ha impedito che il virus entrasse in profondità nei polmoni, ma non vi è stata alcuna differenza nella quantità di RNA virale rilevato dalle secrezioni nasali nelle scimmie vaccinate. È chiaro che, alla luce di questi risultati, conclude Haseltine nel suo commento sul Washington Post, il vaccino non ha fornito immunità sterilizzante ma è in grado di dare solo una protezione parziale. Un dato preoccupante, ha commentato su Twitter John Ball, professore di biologia molecolare della Nottingham University, perché «se una cosa simile si verifica nell’uomo, le persone vaccinate possono comunque essere infettate e rilasciare grandi quantità di virus. Questo potrebbe potenzialmente diffondersi ad altri nella comunità». «Se si ottenessero risultati simili nell’uomo, il vaccino fornirebbe probabilmente una protezione parziale contro le malattie nel ricevente, ma sarebbe improbabile che riduca la trasmissione nella comunità in senso ampio», ha spiegato la professoressa di immunologia e malattie infettive all’Università di Edimburgo, Eleanor Riley.
Intanto, però, dopo l'annuncio di tre settimane fa e i primi test clinici su oltre mille persone divise in due gruppi (a una metà è stato somministrato il vaccino, all'altra metà un placebo) tra Oxford, Southampton, Londra e Bristol, l'istituto si diceva pronto a programmare nuove somministrazioni ad altre 6mila e, in caso di un'approvazione di emergenza da parte delle autorità sanitarie, di rendere disponibili i primi milioni di dosi entro settembre. Il 18 maggio il governo britannico aveva annunciato un ulteriore investimento di 65,5 milioni di dollari nella speranza di poter lanciare una campagna di vaccinazione di massa già il prossimo autunno, prenotando le prime cento milioni di dosi, 30 milioni delle quali dovrebbero essere utilizzate per la fase 2 prevista a settembre, se i test in corso avranno pieno successo. «La velocità con cui l’Università di Oxford ha progettato e organizzato questi complessi studi è davvero senza precedenti», aveva dichiarato il ministro delle Attività Produttive del Regno Unito, Alok Sharma, comunicando la decisione di aumentare le risorse. Invece, la pubblicazione dei risultati dei test sulle scimmie rimette tutto in discussione.
Nella comunicazione di questi "progressi" si innesca un meccanismo per cui un'azienda comunica che le sue sperimentazioni preliminari sono promettenti prima ancora di pubblicare studi sulle piattaforme online o di proporli a riviste scientifiche per avviare un processo di valutazione tra pari, precludendo così la possibilità a medici e scienziati di giungere a proprie conclusioni sulla base delle prove disponibili. Nel frattempo, nell'incertezza delle informazioni che circolano sull'effettiva efficacia dei vari trattamenti o vaccini, le aziende chiedono autorizzazioni d'emergenza, annunciano ulteriori sperimentazioni e pre-annunciano di essere pronti in tempi più o meno brevi per la campagna di vaccinazione sottolineando, al tempo stesso, l'esigenza di grandi investimenti per poter soddisfare il fabbisogno necessario di dosi da utilizzare per le nuove sperimentazioni e l'eventuale somministrazione su larga scala del futuro vaccino che avrà ottenuto l'approvazione dalle varie autorità regolatorie in materia. I governi (e anche soggetti privati come fondazioni e case farmaceutiche) suppliscono a questa domanda da parte delle aziende produttrici di farmaci e vaccini, garantendo fondi per l'acquisto di dosi da destinare poi ai propri cittadini e da vendere agli altri Stati e costruendo delle vere e proprie linee di produzione ancora prima che ci sia qualcosa da produrre. «Inizieremo a incrementare la produzione con le aziende coinvolte. Non c'è tempo per aspettare di vedere delle risposte prima che un'azienda inizi a sviluppare il vaccino», ha dichiarato il dott. Anthony S. Fauci, direttore del NIAID. Negli Stati Uniti, Johnson & Johnson ha promesso di mettere in circolazione entro la fine del prossimo anno un miliardo di dosi di un vaccino che non è stato ancora sviluppato. Il gigante farmaceutico britannico AstraZeneca ha annunciato di aver raggiunto un accordo proprio con l'Università di Oxford per la produzione delle prime 400 milioni di dosi nel caso in cui il vaccino venga approvato e di essere pronta a produrne 1 miliardo tra il 2020 e il 2021. Inoltre, la società anglo-svedese ha dichiarato di aver ricevuto oltre 1 miliardo di dollari di finanziamento dall’Autorità statunitense per la ricerca biomedica avanzata (Barda).
La corsa per il vaccino è, dunque, una gara piena di rischi perché nessuno sa quali progetti avranno successo e ciò costringe le aziende a crescere per produrre milioni di dosi che potrebbero rivelarsi inutili. Un investimento dalle risorse enormi per avere 4 o 5 possibilità ciascuno (gli Stati Uniti, ad esempio, hanno annunciato che contano di finanziare 4 o 5 progetti tra i 14 che attualmente stanno seguendo e sperare che almeno un paio possano arrivare a un vaccino sicuro ed efficace) e garantirsi per primi un bene al momento intangibile. Una scommessa sul futuro in una corsa sempre più accelerata per arrivare per primi, il prima possibile e con più vaccini efficaci possibili che si sta svolgendo in un contesto geopolitico teso con le accuse del governo USA nei confronti della Cina sull'origine del nuovo coronavirus e la gestione dell'epidemia, la dichiarazione di alcuni esponenti dell'amministrazione Trump di voler proteggere eventuali scoperte dal rischio di furti di proprietà da parte dei cinesi, e la minaccia del presidente statunitense di tagliare definitivamente i fondi all'Organizzazione Mondiale della Sanità (OMS) e perfino di ritirare del tutto gli Stati Uniti dall'Organizzazione, accusata – come analizziamo in questo articolo – di non aver lanciato in tempo l'allarme del contagio tra uomo e uomo, di essere Cina-centrica e di aver in un certo modo spinto la disinformazione della Cina, di non aver bloccato in tempo i viaggi da e verso l'Asia e di non aver ascoltato gli avvertimenti di Taiwan e aver escluso il paese dagli incontri.
«I vaccini e le cure per COVID-19 sono come il Santo Graal. La ricerca biomedica ha visto furti in passato, in particolare dal governo cinese. Al di là del valore commerciale, essere i primi oggi avrebbe un grande significato geo-politico. Useremo tutti gli strumenti di cui disponiamo per salvaguardare la ricerca americana», ha dichiarato John C. Demers, vice-procuratore generale per la sicurezza nazionale.
Lo scenario che gli esperti di salute pubblica temono di più è una lotta in tutto il globo in cui i produttori vendono solo ai migliori offerenti e le nazioni in cui si trovano le aziende produttrici accumulano vaccini per i propri cittadini. «Avremo bisogno di molti vaccini diversi per arrivare a quello più efficace. E solo uno sforzo comune può portare al successo finale», aggiunge Anita Zaidi, a capo del programma di sviluppo del vaccino della Bill e Melinda Gates Foundation. «Altrimenti il rischio è che ci siano tanti progetti ma nessuno che emerge in modo chiaro».
C'è bisogno di un coordinamento internazionale per un approccio strategico per la ricerca e sviluppo di un vaccino contro COVID-19, scrivono il dottor Fauci e il direttore del National Institutes of Health, Francis S. Collins, in un articolo recentemente pubblicato su Science: "I costi, il sistema di produzione, le temperature a cui devono essere mantenuti i vaccini per il trasporto, la garanzia di una copertura diffusa in tutto il mondo, sono tutti potenziali punti critici di un'eventuale campagna di vaccinazione globale".
Il rischio è che la tensione tra gli interessi delle industrie farmaceutiche che vogliono trarre il massimo profitto dagli investimenti fatti e la necessità pubblica di un vaccino in tempi brevi, senza uno sforzo comune e privilegiando gli interessi particolari dei singoli Stati, porti a sacrificare la sicurezza in nome della velocità. E invece un vaccino deve essere sicuro ed efficace per evitare che faccia più danni che benefici. Negli anni '50, ad esempio, in poche ore fu approvato un lotto di vaccino anti-poliomelite prodotto male. Conteneva una versione del virus ancora attiva che portò molti pazienti a contrarre la malattia e alcuni bambini a morire. Per questo motivo, commenta Peter Hotez, preside della National School of Tropical Medicine presso Baylor College of Medicine, bruciare le tappe è troppo rischioso per autorità come la FDA. Anche in una situazione di urgenza senza precedenti, come quella attuale, i vaccini dovranno garantire un livello di sicurezza elevato, fanno sapere dalla FDA. «Il mio motto è quello della falegnameria: misura due volte, taglia una volta. L'unica modifica a quel motto è: misurare rapidamente due volte, tagliare rapidamente una volta», ha dichiarato Peter Marks, direttore del Center for Biologics Assessment and Research presso la FDA. Questo fa pensare che non è detto che un qualsiasi vaccino ottenga velocemente il via libera per l'uso pubblico di massa.
Le tipologie di vaccino e le principali aziende coinvolte
Ma si può davvero arrivare ad avere un vaccino in 18 mesi?
"Il vaccino è un bene pubblico globale"
Le tipologie di vaccino e le principali aziende coinvolte
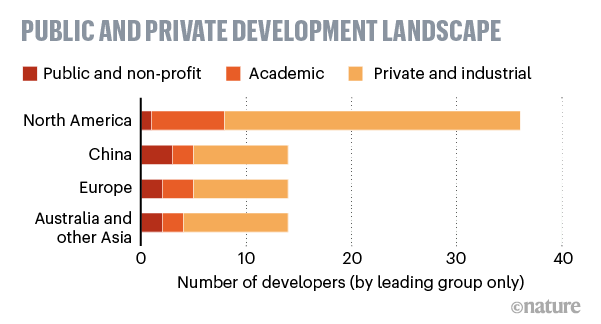
In tutto il mondo sono in corso oltre 100 progetti di vaccino sviluppati da gruppi di ricerca aziendali (oltre il 70%), accademici e pubblici e non-profit. Alcuni si basano su tecnologie tradizionali, altri su tecnologie mai utilizzate in precedenza per vaccini autorizzati sull'uomo. Alcuni studi sono già su gruppi di volontari (fase clinica), altri ancora sugli animali (fase pre-clinica). Gli studi clinici iniziano con il coinvolgimento di un piccolo numero di persone per valutare la sicurezza del vaccino e prime sue indicazioni di efficacia, seguiti poi da fasi su campioni più grandi per confermare l’efficacia e verificare gli effetti collaterali su più ampia scala.
Ci sono quattro principali tipologie di vaccini in sperimentazione che, in modo diverso, cercano tutte di esporre l’organismo a un agente esterno che, senza arrivare a causare la malattia, possa provocare una risposta immunitaria specifica per bloccare o uccidere il SARS-CoV-2 in seguito ad infezione.
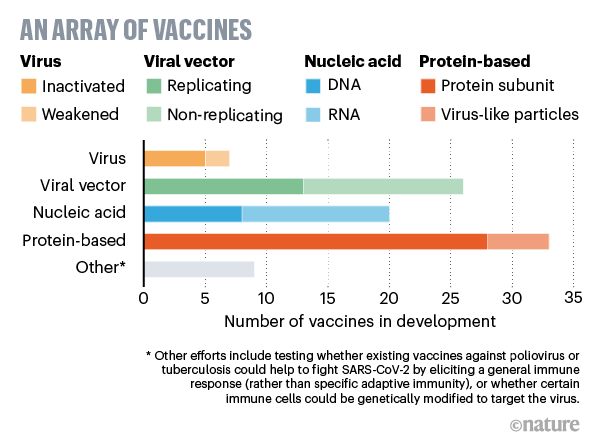
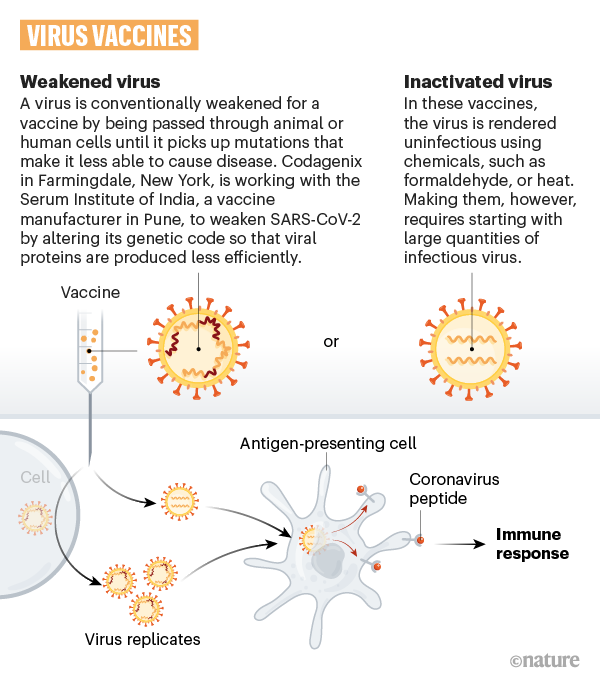
Almeno sette gruppi di ricerca stanno sperimentando il virus stesso in forma indebolita o inattivata (per esempio alterandone il codice genetico con agenti chimici), in modo che non sia in grado di provocare la malattia, ma alla cui presenza estranea le cellule immunitarie dell’organismo rispondano producendo anticorpi. Molti vaccini esistenti, come quelli contro il morbillo e la poliomielite, funzionano in questo modo ma richiedono test di sicurezza approfonditi e grandi quantità di vaccino. Tra le aziende che stano usando questa tecnologia: Sinovac Biotech, in Cina, che ha iniziato i test sull'uomo, e Codagenix, negli USA, che sta lavorando con il Serum Institute of India, uno dei più grandi produttori mondiali di vaccini.
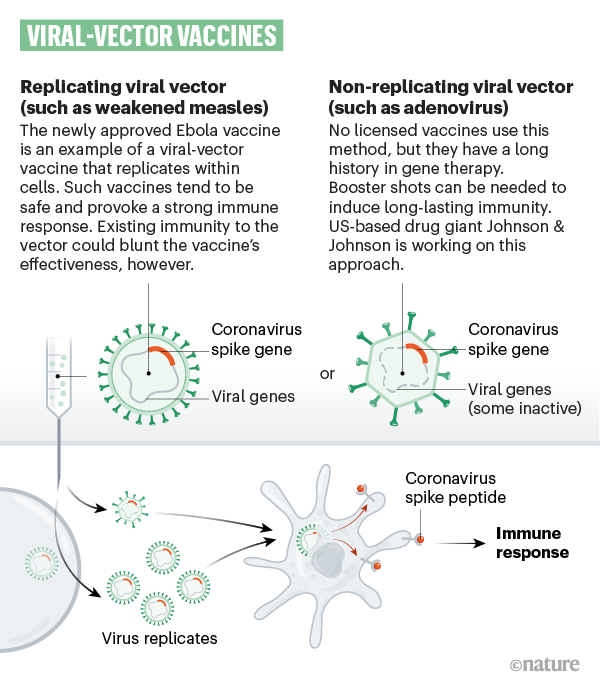
Altri 25 gruppi di ricerca stanno usando un virus diverso (come il morbillo o l'adenovirus) rispetto a quello di interesse, sempre indebolito, ovvero geneticamente modificato in modo da non provocare la malattia, ma che sia in grado di produrre all'interno del corpo umano proteine con una funzione chiave per meccanismo di azione del virus in questione (per esempio, la proteina "spike"). I vaccini contro HIV ed Ebola (che si sono mostrati sicuri e di cui si sta valutando attualmente l'efficacia) rientrano in questa tipologia. Tra le aziende che stanno usando questa tecnologia: Johnson & Johnson, CanSino e l'Università di Oxford.
Venti gruppi stanno iniettando una parte del codice genetico (sotto forma di DNA o RNA) del virus stesso capace di replicarsi e produrre la proteina virale contro cui l’organismo genererà gli anticorpi. Vaccini di questo tipo hanno il vantaggio di poter essere prodotti più rapidamente rispetto a quelli tradizionali, sono utilizzati negli animali (per esempio contro il melanoma canino e il virus del Nilo occidentale nei cavalli), ma non sono mai stati ancora approvati per l’utilizzo nell'uomo. Tuttavia, ci sono sperimentazioni cliniche in corso per vaccini simili contro Zika, influenza, MERS e altre malattie. Tra le aziende che stanno usando questa tecnologia: Inovio, Moderna, Pfizer e BioNtech, e CureVac.
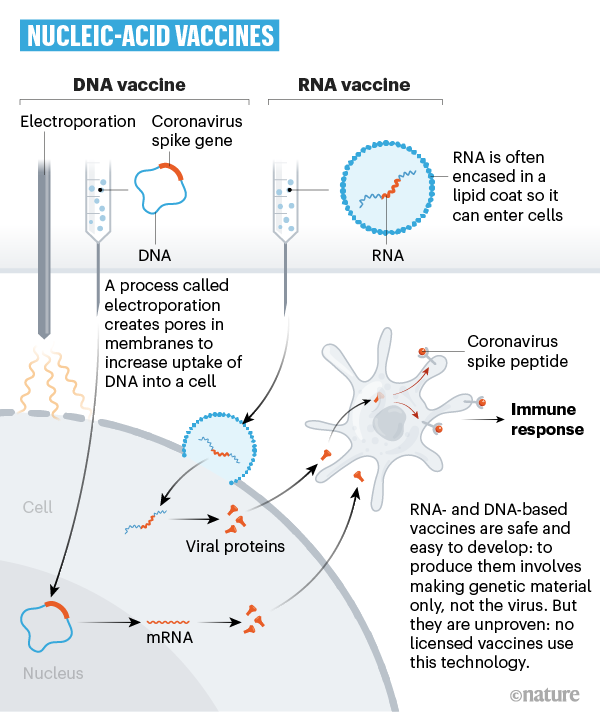
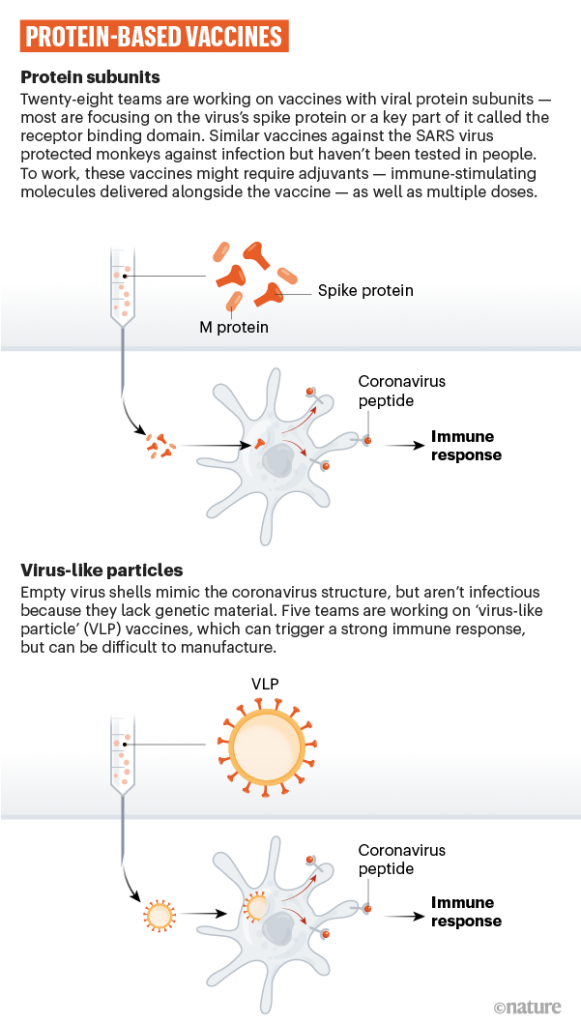
Infine, alcuni gruppi di ricerca stanno provando a iniettare direttamente nel corpo una proteina del virus (principalmente la proteina “spike”), frammenti di essa o un guscio vuoto (privo di materiale genetico) del virus che imita la struttura del virus di interesse. Ancora una volta questi vaccini non possono infettare, ma ugualmente stimolare una risposta immunitaria. Il vaccino contro il papilloma virus umano rientra in questa categoria e vaccini di questo tipo sono stati sperimenti contro l'herpes zoster e l'epatite B. Tra le aziende che stanno usando questa tecnologia: Novavax.
Ma si può davvero arrivare ad avere un vaccino in 18 mesi?
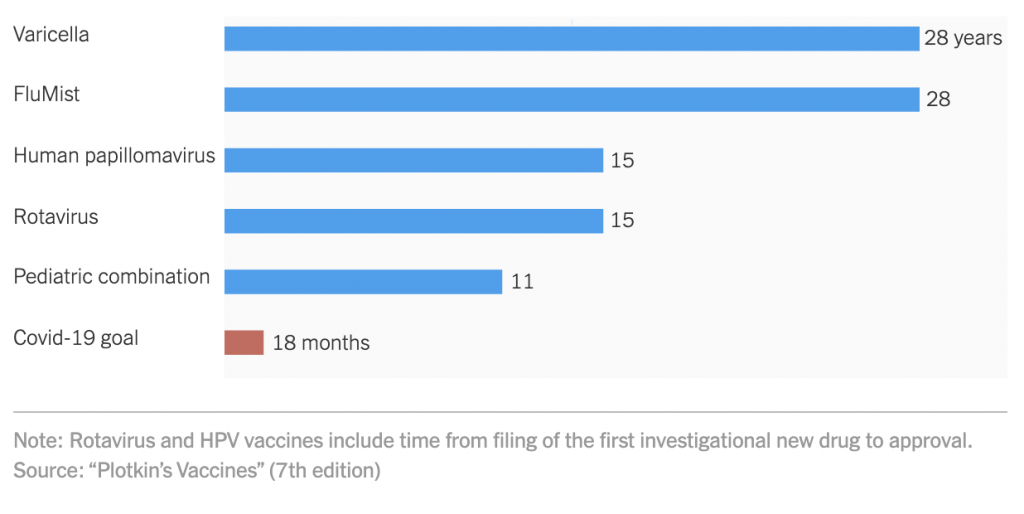
Creare un vaccino è, per certi versi, la parte più semplice. Dimostrare che è sicuro ed efficace e che può essere usato in grandi fasce della popolazione e in grandi quantità può richiedere anni o anche decenni. L’iter tradizionale di approvazione di un vaccino prevede tre fasi. Durante la Fase 1 si testa il vaccino su piccoli gruppi di persone per valutarne la tollerabilità e la sicurezza. La Fase 2 coinvolge alcune centinaia di persone e l'obiettivo è verificare il funzionamento del farmaco e le quantità necessarie perché sia efficace. Nel corso della Fase 3, il vaccino viene sottoposto a migliaia di persone per analizzarne l'efficacia complessiva. Di solito passano mesi tra una fase e l'altra in modo che i ricercatori possano rivedere i risultati e ottenere le approvazioni per le fasi successive. «Facendo in questo modo non ce la faremo mai in 18 mesi», dice al New York Times Akiko Iwasaki, professoressa di immunologia alla Yale School of Medicine e ricercatrice all'Howard Hughes Medical Institute.
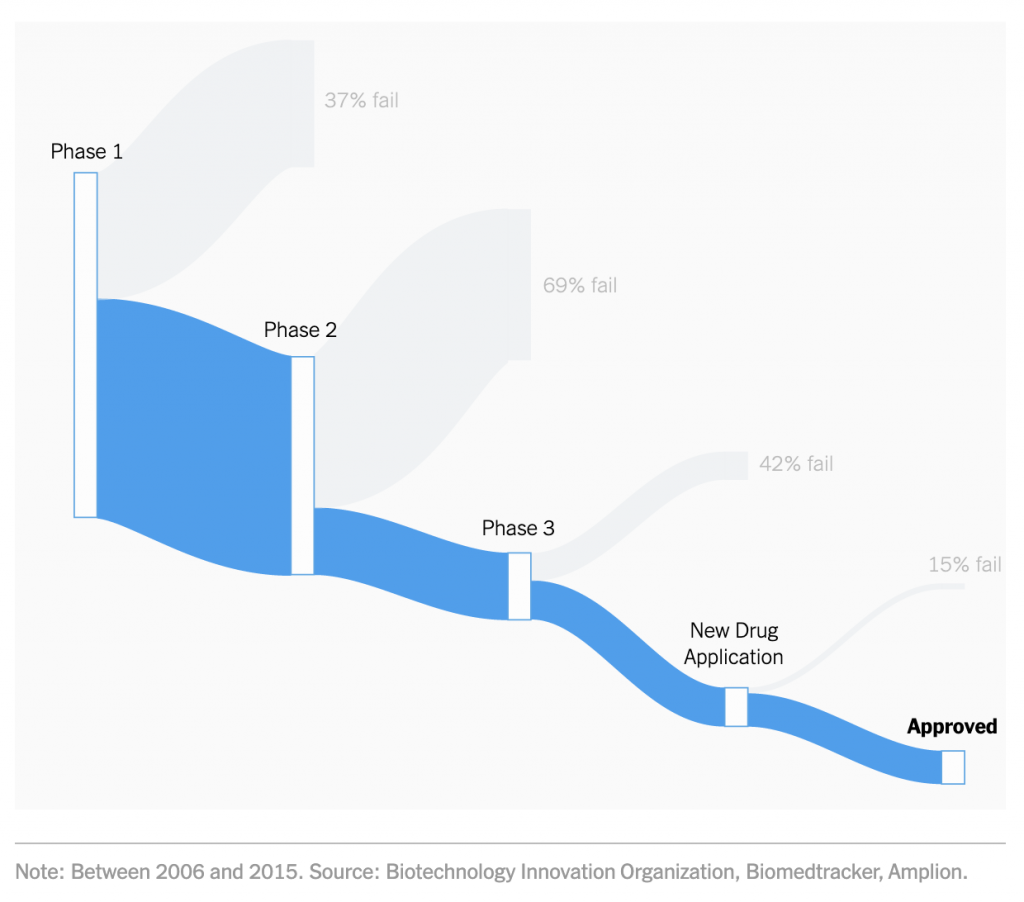
I ricercatori stanno provando a comprimere i tempi di sviluppo, test e approvazione in modi mai visti prima, contro un virus mai affrontato prima d'ora. Da questo punto di vista, può venire in aiuto l'esperienza con SARS e MERS. Gran parte della ricerca scientifica su SARS e MERS si sta rivelando utile perché SARS-CoV-2 è simile per l'80% a SARS e questo ha facilitato la creazione molto veloce di un test per COVID-19. Ma non è detto che questo sia sufficiente ad avere un nuovo vaccino approvato entro 12-18 mesi come dichiarato da governi, aziende farmaceutiche e alcuni laboratori accademici. Anzi, molti esperti sono pessimisti. Meno del 10% dei farmaci che entrano in studi clinici riesce a essere approvato dalla Food and Drug Administration alla fine dell'iter di valutazione. Oltre il 90% fallisce o perché non sono efficaci, o non funzionano meglio dei farmaci esistenti o hanno troppi effetti collaterali.
«Non sappiamo se e quale candidato arriverà al risultato sperato», commenta al Corriere della Sera Sergio Abrignani, immunologo e ordinario di Patologia Statale di Milano. «Nel mondo normale ci vogliono dai cinque ai dieci anni, con una media di otto per arrivare in farmacia con un vaccino. Secondo la mia esperienza, pur con tutte le scorciatoie del caso, sarà difficile avere un vaccino prima di due anni se vogliamo essere certi di due cose fondamentali: che sia sicuro e induca una risposta immunitaria protettiva, possibilmente duratura. Quando sento parlare di un vaccino pronto per settembre per me è fantascienza, e vorrei tanto essere smentito».
Secondo l'Agenzia europea per la medicina (EMA), pensare di approvare un vaccino in un anno è "ottimista". Una delle principali priorità dell'EMA è «sostenere lo sviluppo e l'autorizzazione all'immissione in commercio di terapie e vaccini sicuri, efficaci e di alta qualità il prima possibile», ha dichiarato il direttore esecutivo Guido Rasi. «Tuttavia, la rapida approvazione di terapie e vaccini sarà possibile solo se le applicazioni sono supportate da solide prove scientifiche che consentono all'EMA di concludere un bilancio beneficio-rischio positivo per questi prodotti».
A rallentare i tempi di identificazione e diffusione di un eventuale vaccino ci sono aspetti specifici legati a questo virus e alla pandemia ancora in corso e sue eventuali evoluzioni. Prima di tutto, il funzionamento del nuovo coronavirus, le patologie che provoca e le risposte del sistema immunitario che induce sono conosciute in corso d'opera. Questo rende ancora più incerta ogni prefigurazione su quando (e se) ci sarà un vaccino sicuro ed efficace. A rendere tutto più complicato ci sono poi le condizioni di distanziamento sociale in cui i ricercatori si stanno trovando a lavorare. Come nel caso del National Health Institute: uno scienziato ha contratto il virus e due colleghi hanno dovuto mettersi in quarantena per 14 giorni. O il Graham's Vaccine Research Center che sta lavorando con appena il 10% del personale. Il suo laboratorio, che di solito ospita 20 persone, può averne solo due per volta. Infine, se la pandemia dovesse attenuarsi mancherebbero persone su cui testare in grande quantità il vaccino e ci sarebbero ulteriori rallentamenti.
La scadenza di 12-18 mesi, insomma, potrebbe essere una previsione rosea e inattendibile. Anzi, un obiettivo così alto rischia di compromettere la realizzabilità dei progetti vaccinali attualmente in cantiere, spiega Robert van Exan, biologo cellulare che ha lavorato nel settore dei vaccini per decenni: «Non vedremo l'approvazione di un vaccino fino almeno al 2021 o al 2022 e anche questa è una previsione molto ottimista. Tuttavia, vale la pena provare. Forse saremo fortunati».
Finora il vaccino completamente nuovo autorizzato dalla FDA e immesso nel mercato nel minor tempo possibile è quello per gli orecchioni nel 1967: ci vollero 4 anni per autorizzare la campagna di vaccinazione. Un arco di tempo decisamente alto perché le economie possano reggere più periodi di distanziamento sociale.
Come raggiungere, allora, una meta che sembra così lontana? Il New York Times lo ha chiesto a diversi esperti di vaccini, ha elaborato una serie di grafici interattivi su come si possono ridurre i tempi di produzione di un vaccino contro il nuovo coronavirus comprimendo "in 10 mesi quello che di solito si ottiene in 10 anni" ed è giunto alla conclusione che per rendere più veloce la realizzazione di un vaccino dovranno concorrere più fattori: comprimere i tempi dei test clinici e di approvazione da parte delle autorità regolatorie, fare in modo che le case farmaceutiche siano pronte per una campagna di vaccinazione su larga scala e, soprattutto, trovare un vaccino davvero efficace e sicuro in tempi brevi.
recently became *obsessed* with "experts" who say we could have a vaccine in 12 to 18 months. how is that even possible?
i sketched out all the steps here: https://t.co/Y07EgWg2R5 pic.twitter.com/UTSM5LZhnO
— stuart andrew thompson (@stuartathompson) April 30, 2020
Ma realizzare tutto questo è davvero molto difficile. Innanzitutto, perché un vaccino deve essere efficace e sicuro e, come abbiamo visto, queste sono le cause per cui oltre il 90% dei progetti vaccinali fallisce. La compressione dei tempi dei test clinici non può derogare da questi criteri e il rischio di fallimento potrebbe essere ancora maggiore.
Inoltre, potrebbero esserci dei rallentamenti per la mancata collaborazione internazionale. Se un vaccino si rivela efficace nelle prime prove, le autorità di sorveglianza del farmaco potrebbero autorizzare l'uso d'emergenza, ma i tempi cambiano a seconda dei paesi che per primi ottengono dei risultati. Un paese potrebbe avere tempi più lenti di sviluppo di un altro e la mancata condivisione dei risultati di ricerca potrebbe inficiare una maggiore rapidità nella scoperta del vaccino davvero funzionante.
Infine, l'accelerazione del processo di sviluppo del vaccino deve fare i conti anche con l'evoluzione della pandemia. Usualmente, un vaccino viene iniettato nei familiari di una persona infetta e nelle regioni dove ci sono più casi. Poi si aspetta di vedere come il corpo reagisce, se lo fa in modi imprevisti o se la malattia diventa più violenta. Se la pandemia si attenua, questo passaggio potrebbe subire addirittura dei rallentamenti perché mancherebbero persone su cui testare in grande quantità il vaccino.
Su questo particolare aspetto, in un articolo pubblicato il 31 marzo sul Journal of Infectious Disease, Nir Eyal, Marc Lipsitch e Peter G. Smith hanno proposto di ricorrere allo Human Challenge. Per arrivare il prima possibile a un vaccino – sostengono gli autori – è il caso di provare anche approcci non convenzionali, sempre in condizioni controllate: "Ogni giorno che si perde nello sviluppo di un vaccino significa tante vite umane perse". Leggendo l'articolo, Josh Morrison, un avvocato statunitense, ha avuto l'idea di lanciare il sito "1 Day Sooner" (ndr, "Solo un giorno prima", così denominato proprio per sottolineare la necessità di fare presto).
Migliaia di persone si stanno registrando su questo sito, dando il consenso per partecipare alle sperimentazioni dei vaccini, facendosi infettare intenzionalmente dal virus dopo essere state vaccinate. Si chiama Human Challenge. L'idea è che giovani in buona salute si facciano inoculare dosi basse di virus (via siringa, puntura d'insetto, cocktail o spray nasale) per creare un'immunità controllata e salvare milioni di persone in tutto il mondo.
Nei giorni successivi, la proposta si è fatta strada tra gli esperti fino a venire accreditata anche dall'OMS che il 6 maggio ha pubblicato otto linee guida che delineano la cornice etica in cui i test che si basano sullo Human Challenge possono muoversi. Negli Stati Uniti la FDA si è detta pronta a dare una consulenza sugli aspetti etici e di altro genere a chi vorrà ricorrere a questo tipo di studi clinici.
Lo Human Challenge, hanno spiegato alcuni esperti, può sostituire la terza fase di sperimentazione consentendo ai ricercatori di selezionare dal sito i volontari (accedendo alle loro storie mediche) da infettare direttamente in laboratorio senza aspettare che il campione selezionato contragga il virus in modo organico a lavoro, a scuola, in chiesa o in famiglia, come avviene di solito. Oppure potrebbe configurarsi come una fase intermedia prima di quella conclusiva, consentendo ai ricercatori di determinare quali sono i vaccini più promettenti o permettendo ad alcuni di essi di ottenere una licenza provvisoria. Una delle ipotesi in piedi è iniettare un vaccino sperimentale a 50 volontari e un placebo ad altrettante persone e poi esporre al virus per via nasale tutti e 100 dopo 2 o 4 settimane.
Non si tratta di un approccio mai testato. Questi studi, scrive CNN, hanno avuto un ruolo chiave nello sviluppo di un vaccino contro la malaria, la febbre Dengue e alcune forme d'influenza. È in questo modo che è stato trovato un vaccino contro il tifo in Zimbabwe lo scorso anno. Anni fa, la FDA approvò un vaccino contro il colera solo sulla base dello Human Challenge.
Però quelle malattie presentavano minori incognite rispetto a COVID-19 e i medici che seguivano i volontari sapevano a quali trattamenti ricorrere in caso di insorgenza di sintomi particolari. Nel caso del nuovo coronavirus c'è incertezza anche su quali farmaci utilizzare. E anche gli studi non hanno ancora dati a sufficienza per riuscire a stabilire quali sono i rischi effettivi cui i giovani possono andare incontro. Secondo un articolo pubblicato la scorsa settimana su Science, il tasso di letalità per gli adulti di età compresa tra 20 e 44 anni è inferiore allo 0,2%, ma ci sono stati alcuni casi di ictus tra adulti dai 30 ai 40 anni che hanno destato allarme. «I ricercatori dovranno essere in grado di valutare le condizioni dei volontari e metterli in guardia contro tutti i rischi possibili», spiega Anna Durbin, docente di Salute Internazionale alla Johns Hopkins Bloomberg School of Public Health e autrice di uno studio clinico che ha fatto ricorso allo Human Challenge per la febbre Dengue e la malaria. «Ciò che non mi fa dormire la notte è se una persona si ammala gravemente o muore perché non sono stata attenta», aggiunge Durbin.
Infine c'è una questione etica: quanto pagare i partecipanti? Né troppo poco da disincentivare la partecipazione né eccessivamente in modo tale da attirare persone disposte a tutto, anche a correre un rischio eccessivo per la propria salute. «Le persone sono disposte ad assumersi rischi potenzialmente letali a beneficio di altre persone e spesso non solo come lavoro ma come forma di altruismo», commenta Lipsitch. «Non solo incoraggiamo questo, ma dipendiamo completamente da ciò in molti settori della nostra vita».
Le aziende farmaceutiche dovranno farsi trovare pronte a diffonderlo in grandi quantità
Trovato un vaccino efficace e sicuro, le case farmaceutiche dovranno farsi trovare pronte per produrre milioni (o forse miliardi) di dosi. Per le particolari procedure di produzione dei vaccini, ci vogliono anche cinque anni per costruire le fabbriche dove coltivarli e investimenti almeno tre volte superiori rispetto a quelli richiesti da quelle farmaceutiche convenzionali. Si possono ridurre i tempi riutilizzando nel corso dei test clinici strutture già esistenti in attesa che il vaccino ottenga l'approvazione della FDA. «In questo modo almeno possiamo provarci. Se poi il vaccino non risulterà efficace e sicuro e non otterrà l'approvazione, non verrà messo in distribuzione», spiega Iwasaki.
Solo inserire i vaccini nelle fiale è molto oneroso: ce ne vogliono miliardi e per riempirle, tapparle e ispezionarle servono macchine sofisticate. Poi vanno immagazzinate, spedite e rilasciate al pubblico utilizzando camion e strutture a temperatura controllata. Se non ci si fa trovare pronti, potrebbe crearsi lo stesso collo di bottiglia che ha causato la carenza di ventilatori, mascherine e dispositivi di protezione individuale negli ospedali mentre SARS-CoV-2 si propagava dappertutto.
Da questo punto di vista, il metodo mRNA potrebbe ridurre i tempi di produzione dei vaccini perché invece di iniettare alle persone antigeni specifici della malattia per stimolare la produzione di anticorpi, iniettando mRNA si danno all'organismo le istruzioni per creare quegli antigeni stessi. Poiché i vaccini mRNA non devono essere coltivati in grandi quantità e quindi purificati, sono molto più veloci da produrre. Tuttavia, spiega il dottor Van Exan, «nessuno ha mai fatto un vaccino RNA per l'uomo» e quindi le incognite sono tante.
"Il vaccino è un bene pubblico globale"
La ricerca del vaccino contro il nuovo coronavirus non è solo una questione di salute pubblica ma ha implicazioni di carattere politico, economico, industriale e si inserisce in un contesto geo-politico molto teso tale da minare la collaborazione internazionale per uno sforzo comune e congiunto nella ricerca di un vaccino che funzioni e sia sicuro.
Mentre scienziati e medici esortano i governi di tutto il mondo a collaborare intendendo il vaccino come un bene pubblico globale, alcuni paesi hanno avviato insieme ad alcune aziende produttrici di vaccini e alcune case farmaceutiche catene di produzione nazionali, enfatizzando un "approccio nazionalista" dello stile "prima il mio paese" e poi gli altri.
È questo l'orientamento adottato, come abbiamo visto, dall'amministrazione Trump, che non sta partecipando all'iniziativa mondiale ACT Accelerator (che ha raccolto più di 8 miliardi di dollari per il vaccino contro il coronavirus) e sta optando per una strategia unilaterale attraverso un suo programma di sviluppo chiamato "Operation Warp Speed".
Stephen Morrison, che gestisce il programma sanitario globale presso il Center for Strategic and International Studies, ha osservato che la Casa Bianca non ha confermato l'intenzione di partecipare al prossimo vertice globale virtuale sui vaccini fissato per il 4 giugno: «Sembra che stia adottando un approccio "America First". Il rischio è che questo allontanamento comprometta gli sforzi internazionali e crei tensioni, incertezze e insicurezze». La pandemia di coronavirus è la sfida globale per antonomasia, affermano gli esperti. Un buon vaccino potrebbe non conferire immunità a lungo termine, il che significa che il virus non sarà sconfitto da nessuna parte finché non sarà sconfitto ovunque.
«È strano avere una storia di collaborazione nelle scienze biomediche così ricca e poi decidere, in un momento come questo, per motivi che sono difficili da capire, che vuoi affrontare da solo un problema globale. Quando la collaborazione è più necessaria che mai», aggiunge al Guardian Paul Duprex, direttore del Center for Vaccine Research presso l'Università di Pittsburgh.
Trump si è messo in contatto con un'azienda tedesca per acquisire la sua ricerca sui vaccini e ha finanziato di quasi mezzo miliardo di dollari Johnson & Johnson, che fa ricerca nei Paesi Bassi, ma ha trovato un accordo con la EmergentBioSolutions, una società del Maryland, per produrre i primi grandi lotti di un vaccino approvato per gli USA.
Anche altri paesi stanno perseguendo questo approccio. Come detto, la sperimentazione clinica più promettente in Cina è finanziata dal governo, anche se il presidente Xi Jinping ha recentemente affermato che se Pechino dovesse trovare un vaccino contro il COVID-19 ne farebbe «un bene pubblico mondiale». E in India, il direttore generale del Serum Institute of India vuole dare priorità agli indiani.
Ha fatto molto discutere nei giorni scorsi una dichiarazione di Paul Hudson, il manager britannico al vertice della multinazionale francese Sanofi, in un’intervista all’agenzia Bloomberg. Nel caso in cui il vaccino poi messo sul mercato fosse quello prodotto nei cinque stabilimenti di Sanofi negli Stati Uniti, sarebbe logico che venisse messo a disposizione degli USA prima che nel resto del mondo, ha detto Hudson. Quest'affermazione ha suscitato la reazione del governo francese tanto da essere poi ritrattate dall'azienda: «Per noi sarebbe inaccettabile un accesso al vaccino privilegiato da parte di un Paese o un altro per ragioni pecuniarie», ha detto la segretaria di Stato all’Economia Agnès Pannier-Runacher.
La corsa individuale al vaccino non promette nulla di buono, scrivono Christopher Rowland, Carolyn Y. Johnson e William Wan sul Washington Post. Si corre il rischio che di fronte all'esigenza di tutta la popolazione mondiale di una vaccinazione, ci saranno aree del mondo che saranno riuscite a sviluppare un vaccino e altre invece che faranno fatica a trovarne uno. «È un approccio miope e sciocco. In questo modo si sperpereranno dosi su un gran numero di persone a basso rischio invece di coprire quelle ad altro rischio a livello globale», dice al New York Times, George Q. Daley, preside della Scuola di Medicina di Harvard.
«Nessuno di noi può accettare un mondo in cui alcune persone sono protette e altre no», ha dichiarato di recente Tedros Adhanom Ghebreyesus, direttore generale dell'OMS, nel corso di una teleconferenza. «Tutti dovrebbero essere protetti. Nessuno di noi è al sicuro finché non siamo tutti al sicuro».
Gli Stati Uniti, scrive il Washington Post, stanno giocando una partita pericolosa perché potrebbero pagare con l'isolamento questo loro approccio "nazionalista" nel caso in cui il vaccino arrivasse poi da un altro paese o da una collaborazione internazionale. «La questione è che non c'è un protocollo internazionale, una piattaforma pre-esistente sulla quale basarsi per coordinarsi sulla produzione e diffusione dei vaccini. In sostanza, si tratta di negoziare», spiega al Washington Post Jeremy Konyndyk, esperto del Center for Global Development e consulente dell'amministrazione Obama per le catastrofi internazionali. In pratica non è stato imparato nulla da quanto avvenne 11 anni fa con l'influenza H1N1, ricostruisce il Washington Post, quando i paesi più ricchi si misero al sicuro con contratti di fornitura con le aziende produttrici di vaccini e i paesi più poveri ebbero accesso alle scorte in ritardo. Da allora sono state istituite strutture più solide per i vaccini anti-influenzali che non si applicano però automaticamente al coronavirus. «I paesi ricchi sono i migliori clienti per le aziende che producono vaccini per il rientro degli investimenti», spiega David Fidler, esperto di sicurezza informatica e salute globale presso il Consiglio sulle Relazioni Internazionali.
Nel caso dell'influenza H1N1 oltre 80 milioni di americani furono vaccinati nel 2009, utilizzando lo stesso numero di dosi ricevute da 77 paesi nell'ambito di un piano vaccinale dell'OMS. Un approccio del genere potrebbe essere poco efficace di fronte a una pandemia come quella del nuovo coronavirus perché spegnere un focolaio in alcune aree del mondo non serve a nulla se ci sono altri focolai attivi in altre parti del pianeta. Per questo motivo c'è bisogno di un approccio globale e il vaccino va inteso come un bene pubblico globale, commenta David Pilling sul Financial Times.
"Immagina se, tra un anno, 300 milioni di dosi di un vaccino COVID-19 sicuro ed efficace siano state prodotte in America di Donald Trump, in Cina di Xi Jinping o in Gran Bretagna di Boris Johnson. Chi li prenderà? Quali sono le possibilità che un'infermiera in India o un medico in Brasile, per non parlare di un autista di autobus in Nigeria o di un diabetico in Tanzania, avranno la priorità? (...) Il vaccino dovrà essere disponibile sia per i poveri del mondo che per i suoi ricchi. Ciò significherà dare la priorità a medici, infermieri e altri lavoratori in prima linea, nonché a quelli più vulnerabili alla malattia, indipendentemente da dove vivono o da quanto possono permettersi", scrive Filling. Una pandemia si sconfigge distribuendo "inizialmente quantità limitate di vaccino isolando ed eliminando i focolai lì dove sorgono nelle diverse regioni del pianeta, come è stato fatto con successo contro l'Ebola lo scorso anno nella Repubblica Democratica del Congo. Con COVID-19, questo sembra un sogno irrealizzabile. Lungi dal riunire il mondo, la pandemia ha messo in luce una crisi di disunità internazionale. La produzione dovrà inoltre essere sparsa su tutte le aree del mondo per garantire che un vaccino possa essere distribuito a livello globale perché il vaccino contro COVID-19 deve essere utilizzato come un bene pubblico globale".
Immagine in anteprima via pixabay.com







